'세계 최초의 골관절염 유전자 치료제' 인보사가 결국 허가 취소되고, 개발사 코오롱생명과학과 이우석 대표가 검찰에 고발됐다. 지난 2017년 7월부터 시판이 허가돼 1회 주삿값만 700만 원으로 3700여 명에게 투약된 인보사가 '완전 사기극'으로 드러나면서 파장이 걷잡을 수 없게 됐다.
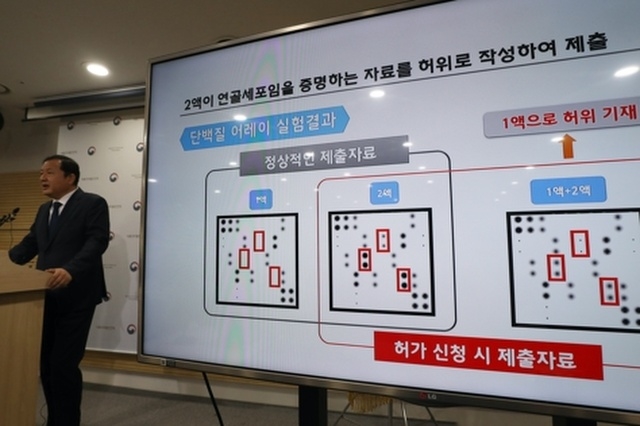
28일 식품의약품안전처가 발표한 조사 결과에 따르면, 코오롱생명과학이 2016년 식약처에 제출한 성분 자료 자체가 허위다. 암을 유발할 수 있는 신장유래세포가 성분에 포함된 것을 알면서도, 연골유래세포 성분만 있다는 자료를 제출했다는 것이다. 또한 연골세포의 성장을 촉진하기 위해 삽입된 핵심성분 TGF베타 유전자와 관련된 중요한 정보가 변동된 사실을 알고도 코오롱생명과학은 이를 숨긴 사실도 드러났다. 유전자와 관련된 정보는 유전자 치료제의 품질과 일관성을 좌우하기 때문에 변동 사항이 있으면 보고해야 된다.
또한 코오롱 측은 2017년 식약처의 허가를 받기 전 미국의 인보사 위탁생산업체의 검사 결과 신장유래세포가 들어있다는 사실을 확인받고도 역시 숨긴 것으로 드러났다.
신약 허가 식약처 신뢰 무너져
코오롱생명과학은 지난 3월 미국 식품의약국(FDA)가 인보사에 연골유래세포가 아닌 신장유래세포가 들어있다는 사실이 발각된 뒤에야 판매를 중단했다.
인보사를 무리하게 허가를 내줬다는 의혹으로 시민단체에 의해 검찰에 고발된 식약처는 인보사 사태가 터진 이후인 지난 4월부터 조사에 착수해 인보사에 대해 허가 취소 등의 조치를 결정했다.
하지만 코오롱생명과학 측은, 처음부터 연골유래세포가 아닌 신장유래세포가 들어있었다는 것을 알고도 속인 것인지, 어떤 경위로 신장유래세포가 들어가게 된 것인지에 대해 자료 제출을 거부하고 있다.
도대체 코오롱생명과학이 환자의 생명을 담보로 어디까지 당국과 시장을 우롱해왔는지 식약처는 조사 역량과 권한의 한계로 밝혀내지 못했다는 입장이다. 식약처는 '인보사'의 안전성에 대한 환자들의 우려가 크기 때문에, '인보사' 전체 투여 3707건에 대한 특별 관리와 15년간 장기추적 조사를 진행할 계획이다.
하지만 인보사처럼 신약 허가 심사 자체가 업체 측이 제출한 자료에 식약처가 거의 전적으로 의존하는 현실이 드러나면서 식약처의 심사 과정 자체에 대한 신뢰는 무너진 상황이다.
이미 환자들은 손해배상청구 소송에 나섰다. 법무법인 오킴스는 인보사 투여환자들을 모집해 1차로 서류 준비가 완료된 244명을 대표해 코오롱생명과학을 상대로 이날 서울중앙지방법원에 손해배상을 청구하는 소장을 제출하기로 했다.
식약처 결정으로 코스닥 상장업체로 인보사의 연구개발을 진행한 미국 법인 코오롱티슈진과 코오롱생명과학 주식 거래도 이날 정지됐다.



전체댓글 0